Los números cuánticos son valores numéricos que indican las
características de los electrones de los átomos, sobre la base de la
teoría cuántica y la ecuación de Schrödinger, las cuales sustentan el
modelo atómico más aceptado y utilizado en los últimos tiempos. Los
números atómicos más importantes son cuatro:
Número Cuántico
Principal (n ). Indica en qué nivel se encuentra el electrón, y el
tamaño de la nube electrónica. Puede tomar valores enteros positivos a
partir de 1.
Número Cuántico Secundario, Azimutal o de Momento
Angular (l ). Indica en qué subnivel se encuentra el electrón, y la
forma de la nube electrónica. Toma valores desde 0 hasta (n - 1).
l = 0 orbital "s" (sharp)
l = 1 orbital "p" (principal)
l = 2 orbital "d" (diffuse)
l = 3 orbital "f" (fundamental)
n=1, 2,3
l= 0,1, 2,3
m=-l…0…1l
s=+1/2. -1/2
Ejemplo:
Na 11 = 1s2, 2s2, 2p6, 3s1
n=3
l=0
m=0
s=+1/2
l=orbital
0-s
1-p
2-d
3-f
n= 0
0-s= ,
1-p -1, 0,+1
2-d -2,-1, 0,+1,+2
3-f -3,-2,-1, 0,+1,+2,+3
¿Que es el enlace covalente iónicos y covalentes? Y ¿Cómo se forman?
Ionico:
Es
el enlace que se da entre elementos de electronegatividades muy
diferentes. Se produce una cesión de electrones del elemento menos
electronegativo al mas electronegativo y se forman los respectivos iones
positivos (los que pierden electrones) y negativos (los átomos que
ganan los electrones).
Este tipo de enlace suele darse entre
elementos que están a un extremo y otro de la tabla periódica. O sea, el
enlace se produce entre elementos muy electronegativos (no metales) y
elementos poco electronegativos (metales).
¿Qué mantiene la unión?
La
fuerza de atracción entre las cargas positivas y las cargas negativas
que se forman; es decir, la fuerza de atracción entre los cationes y los
aniones.
¿Se forman moléculas?
No, se forman
redes cristalinas (ordenadas). Por tanto, los iones que se forman con
este enlace no forman moléculas aisladas sino que se agrupan de forma
ordenada en redes en las que el número de cargas positivas es igual al
de cargas negativas, compuesto es neutro.
Propiedades
*
Temperaturas de fusión y ebullición muy elevadas. Sólidos a temperatura
ambiente. La red cristalina es muy estable por lo que resulta muy
difícil romperla.
* Son duros (resistentes al rayado).
*
No conducen la electricidad en estado sólido, los iones en la red
cristalina están en posiciones fijas, no quedan partículas libres que
puedan conducir la corriente eléctrica.
* Son solubles en agua
por lo general, los iones quedan libres al disolverse y puede conducir
la electricidad en dicha situación.
* Al fundirse también se liberan de sus posiciones fijas los iones, pudiendo conducir la electricidad.
Enlace iónico
¿Qué es el enlace covalente?
Es
el enlace que se da entre elementos de electronegatividades altas y muy
parecidas, en estos casos ninguno de los átomos tiene más posibilidades
que el otro de perder o ganar los electrones. La forma de cumplir la
regla de octeto es mediante la compartición de electrones entre dos
átomos. Cada par de electrones que se comparten es un enlace.
Este tipo de enlace se produce entre elementos muy electronegativos (no metales).
Los electrones que se comparten se encuentran localizados entre los átomos que los comparten.
¿Qué mantiene la unión?
La
fuerza de atracción entre las cargas positivas y las cargas negativas
que se forman; es decir, la fuerza de atracción entre los cationes y los
aniones.
¿Se forman moléculas?
No, se forman
redes cristalinas (ordenadas). Por tanto, los iones que se forman con
este enlace no forman moléculas aisladas sino que se agrupan de forma
ordenada en redes en las que el número de cargas positivas es igual al
de cargas negativas, compuesto es neutro. La fórmula que habitualmente
se da es una fórmula empírica.
Propiedades
*
Temperaturas de fusión y ebullición muy elevadas. Sólidos a temperatura
ambiente. La red cristalina es muy estable por lo que resulta muy
difícil romperla.
* Son duros (resistentes al rayado).
*
No conducen la electricidad en estado sólido, los iones en la red
cristalina están en posiciones fijas, no quedan partículas libres que
puedan conducir la corriente eléctrica.
* Son solubles en agua
por lo general, los iones quedan libres al disolverse y puede conducir
la electricidad en dicha situación.
* Al fundirse también se liberan de sus posiciones fijas los iones, pudiendo conducir la electricidad.
enlace covalente cloro
domingo, 7 de octubre de 2012
lunes, 1 de octubre de 2012
PRINCIPIO DE CONSTRUCCIÓN O DE AUF-BAU
En el estado
fundamental de un átomo, los electrones ocupan orbítales atómicos de tal
modo que la energía global del átomo sea mínima.
Se denomina principio de construcción (Aufbau) al procedimiento para deducir la configuración electrónica de un átomo, y consiste en seguir un orden para el llenado de los diferentes orbítales, basado en los diferentes valores de la energía de cada uno de ellos. Para recordarlo se utiliza el diagrama de Möller o de las diagonales, así como la regla de la mínima energía (n+l)..
Se denomina principio de construcción (Aufbau) al procedimiento para deducir la configuración electrónica de un átomo, y consiste en seguir un orden para el llenado de los diferentes orbítales, basado en los diferentes valores de la energía de cada uno de ellos. Para recordarlo se utiliza el diagrama de Möller o de las diagonales, así como la regla de la mínima energía (n+l)..
 ¡ES LO MISMO QUE LA CONFIGURACION ELECTRONICA LEER POR FAVOR NUEVAMENTE!
¡ES LO MISMO QUE LA CONFIGURACION ELECTRONICA LEER POR FAVOR NUEVAMENTE!
Configuracion electronica
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía.
Aunque el modelo de Scrödinger es exacto sólo para el átomo de
hidrógeno, para otros átomos es aplicable el mismo modelo mediante
aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal,
para ello debes seguir atentamente la flecha del esquema comenzando en
1s; siguiendo la flecha podrás ir completando los orbitales con los
electrones en forma correcta.
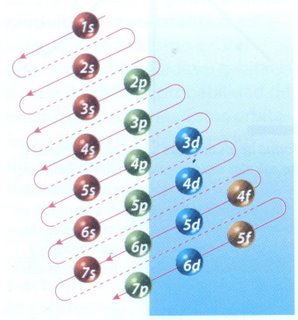
Para escribir la configuración electrónica de un átomo es necesario:
- Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Niels Bohr
Niels Bohr
(Niels Henrick David Bohr; Copenhague, 1885 - 1962)
Físico danés. Considerado como una de las figuras más deslumbrantes de
la Física contemporánea y, por sus aportaciones teóricas y sus trabajos
prácticos, como uno de los padres de la bomba atómica, fue galardonado
en 1922 con el Premio Nobel de Física, "por su investigación acerca de la estructura de los átomos y la radiación que emana de ellos".
Cursó
estudios superiores de Física en la Universidad de Copenhague, donde
obtuvo el grado de doctor en 1911. Tras haberse revelado como una firme
promesa en el campo de la Física Nuclear, pasó a Inglaterra para ampliar
sus conocimientos en el prestigioso Cavendish Laboratory de la
Universidad de Cambridge, bajo la tutela de sir Joseph John Thomson
(1856-1940), químico británico distinguido con el Premio Nobel en 1906
por sus estudios acerca del paso de la electricidad a través del
interior de los gases, que le habían permitido descubrir la partícula
bautizada luego por Stoney (1826-1911) como electrón.
Ecuacion de Scrodinger
El físico austríaco, Erwin Schrodinger, desarrolló en 1925 la conocida ecuación que lleva su nombre. Esta ecuación es de gran importancia en la mecánica cuántica, donde juega un papel central, de la misma manera que la segunda ley de Newton en la mecánica.
Fue entre 1925 y 1930, cuando apareció la teoría de la mecánica cuántica, de la mano de un grupo de investigadores, donde destacaba Erwin Schrödinger. Esta teoría fue importante, no sólo por su relevancia e importante papel en la ciencia, sino también por la gran cantidad de conceptos científicos implicados en ella.
Son muchos los conceptos previos implicados en la ecuación de Schrödinger, empezando por los modelos atómicos. Dalton, Thomson, Rutherford, Bohr, todos ellos contribuyeron al modelo atómico actual, ideado por Erwin Schrödinger, modelo conocido como “Ecuación de onda”. Esta es una ecuación matemática que tiene en consideración varios aspectos:
- La existencia de un núcleo atómico, donde se concentra la gran cantidad del volumen del átomo.
- Los niveles energéticos donde se distribuyen los electrones según su energía.
- La dualidad onda-partícula
- La probabilidad de encontrar al electrón
E = h ν
p = h / λ
Schrödinger trató de escribir una ecuación siguiendo la anterior predicción de De Broglie pero reduciendo las escalas macroscópicas e la ecuación de la mecánica clásica, expresandose la energñia mecánica total como:
E= p^2 / 2m + V ( r )
Max Born dio una
correcta interpretación física para la función de la función de
Schrödinger en 1926, sin embargo el carácter probabilístico introducido
por Schrödinger provocó mucha desconfianza en los físicos, incluso
aquellos con renombre, como por ejemplo, Albert Einstein.La solución de esta ecuación, fue la función de onda, siendo ésta, una medida de probabilidad de encontrar al electrón en un espacio, conocido como orbital.
Las funciones de onda se transforman con el tiempo, siendo su evolución temporal estudiada en la famosa ecuación del físico austríaco.
Otros conceptos utilizados por Schrödinger se basan en la óptica y la mecánica, y el paralelismo de ambas. A inicios de los años 30, Born le dio una interpretación probabilística distinta a la función de onda a la que De Broglie y Schrödinger habían dado, lo que le supuso el premio Nobel. En este trabajo, Born vio mediante formulas matriciales de mecánica cuántica, que los conjuntos cuánticos de estados, de manera natural construían espacios de Hilbert, para poder representar los estados físicos en cuántica.
Actualmente la ecuación se formula según la mecánica cuántica, donde el estado en un instante t, de un sistema definido por un elemento │Ψ ( t ) > en el espacio de Hilbert y usando la notación de Dirac , se pueden representar todos los resultados posibles de todas las medidas de un sistema.
Con la ecuación de Schrödinger describe la evolución temporal de │Ψ ( t ) > :
Niveles de energia
NIVELES DE ENERGIA
Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:
La Banda de Valencia y la Banda de Conducción.
La Banda de Valencia es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.
El átomo de Sodio (Na) tiene 11 electrones, 2 en la primera capa, 8 en la segunda y 1 en la tercera, y el Cloro (Cl) tiene 17 electrones, 2 en la primera, 8 en la segunda y 7 en la tercera. Debido a que todos los átomos tienden a tener 8 electrones en la última capa (regla del octete): el Sodio cederá 1 electrón al Cloro con lo que el primero se quedará con 8 electrones en su ahora última capa, en cambio el Cloro aceptará ese electrón pasando su última capa de tener 7 electrones a 8
Orbital
Orbital
Son los atomos que tienen niveles de energia, estos tienen subniveles, y estos a
su vez contienen orbitales, estos son "orbitas" donde los electrones
estan por parejas, ya que ada orbital acepta solamente 2 electrones!
practicamente el orbital es el lugar que ocupa una pareja de electrones dentro del subnivel.
Cada subnivel acepta diferentes numeros de orbitales
el subnivel S (acepta 2 electrones) = 1 orbital!
// P (acepta 6 electrones)= 3 orbitales
// D( acepta 10 electrones)= 5 orbitales
// F ( acepta 14 electrones)= 7 orbitales
practicamente el orbital es el lugar que ocupa una pareja de electrones dentro del subnivel.
Cada subnivel acepta diferentes numeros de orbitales
el subnivel S (acepta 2 electrones) = 1 orbital!
// P (acepta 6 electrones)= 3 orbitales
// D( acepta 10 electrones)= 5 orbitales
// F ( acepta 14 electrones)= 7 orbitales
Philip Allen Sharp
Philip Allen Sharp
(Falmouth, 1944) Químico e investigador norteamericano
que obtuvo el premio Nobel de Medicina en 1993 por sus descubrimientos
sobre la estructura de los genes. Realizó la carrera de Ciencias
Químicas en la Universidad de Illinois, estudió en el Instituto de
Tecnología de California, y de 1966 a 1969 fue investigador en el
departamento de Química de la Universidad de Illinois.
En
1964 contrajo matrimonio con Ann H. Holcombe, con quien tuvo tres
hijas. Entre 1969 y 1971 realizó estudios de postgrado en el laboratorio
del profesor Norman Davidson del Instituto Tecnológico de California.
En 1971 fue investigador en el laboratorio de Cold Spring Harbor, de
Nueva York, donde permaneció hasta 1974 y coincidió con el investigador
británico Richard J. Roberts.
Profesor asociado
(1974) y profesor desde 1979 del Centro para la Investigación sobre el
Cáncer, fue designado en 1982 director asociado de esta institución,
cargo en el que permaneció hasta 1985. Desde esa fecha desempeñó el
cargo de subdirector. Desde 1974 fue investigador del Instituto
Tecnológico de Massachusets, MIT, en Cambridge. En 1991 asumió el cargo
de director del departamento de Biología.
El 11 de
octubre de 1993 Phillip Sharp y Richard J. Roberts fueron galardonados
con el Premio Nobel de Medicina por sus descubrimientos sobre la
estructura de los genes. Ambos investigadores lograron descubrir, por
separado, que los genes pueden aparecer en el material genético en
varios segmentos bien diferenciados. Sharp había comenzado a investigar
este asunto en 1970.
Suscribirse a:
Comentarios (Atom)











