Los números cuánticos son valores numéricos que indican las
características de los electrones de los átomos, sobre la base de la
teoría cuántica y la ecuación de Schrödinger, las cuales sustentan el
modelo atómico más aceptado y utilizado en los últimos tiempos. Los
números atómicos más importantes son cuatro:
Número Cuántico
Principal (n ). Indica en qué nivel se encuentra el electrón, y el
tamaño de la nube electrónica. Puede tomar valores enteros positivos a
partir de 1.
Número Cuántico Secundario, Azimutal o de Momento
Angular (l ). Indica en qué subnivel se encuentra el electrón, y la
forma de la nube electrónica. Toma valores desde 0 hasta (n - 1).
l = 0 orbital "s" (sharp)
l = 1 orbital "p" (principal)
l = 2 orbital "d" (diffuse)
l = 3 orbital "f" (fundamental)
n=1, 2,3
l= 0,1, 2,3
m=-l…0…1l
s=+1/2. -1/2
Ejemplo:
Na 11 = 1s2, 2s2, 2p6, 3s1
n=3
l=0
m=0
s=+1/2
l=orbital
0-s
1-p
2-d
3-f
n= 0
0-s= ,
1-p -1, 0,+1
2-d -2,-1, 0,+1,+2
3-f -3,-2,-1, 0,+1,+2,+3
¿Que es el enlace covalente iónicos y covalentes? Y ¿Cómo se forman?
Ionico:
Es
el enlace que se da entre elementos de electronegatividades muy
diferentes. Se produce una cesión de electrones del elemento menos
electronegativo al mas electronegativo y se forman los respectivos iones
positivos (los que pierden electrones) y negativos (los átomos que
ganan los electrones).
Este tipo de enlace suele darse entre
elementos que están a un extremo y otro de la tabla periódica. O sea, el
enlace se produce entre elementos muy electronegativos (no metales) y
elementos poco electronegativos (metales).
¿Qué mantiene la unión?
La
fuerza de atracción entre las cargas positivas y las cargas negativas
que se forman; es decir, la fuerza de atracción entre los cationes y los
aniones.
¿Se forman moléculas?
No, se forman
redes cristalinas (ordenadas). Por tanto, los iones que se forman con
este enlace no forman moléculas aisladas sino que se agrupan de forma
ordenada en redes en las que el número de cargas positivas es igual al
de cargas negativas, compuesto es neutro.
Propiedades
*
Temperaturas de fusión y ebullición muy elevadas. Sólidos a temperatura
ambiente. La red cristalina es muy estable por lo que resulta muy
difícil romperla.
* Son duros (resistentes al rayado).
*
No conducen la electricidad en estado sólido, los iones en la red
cristalina están en posiciones fijas, no quedan partículas libres que
puedan conducir la corriente eléctrica.
* Son solubles en agua
por lo general, los iones quedan libres al disolverse y puede conducir
la electricidad en dicha situación.
* Al fundirse también se liberan de sus posiciones fijas los iones, pudiendo conducir la electricidad.
Enlace iónico
¿Qué es el enlace covalente?
Es
el enlace que se da entre elementos de electronegatividades altas y muy
parecidas, en estos casos ninguno de los átomos tiene más posibilidades
que el otro de perder o ganar los electrones. La forma de cumplir la
regla de octeto es mediante la compartición de electrones entre dos
átomos. Cada par de electrones que se comparten es un enlace.
Este tipo de enlace se produce entre elementos muy electronegativos (no metales).
Los electrones que se comparten se encuentran localizados entre los átomos que los comparten.
¿Qué mantiene la unión?
La
fuerza de atracción entre las cargas positivas y las cargas negativas
que se forman; es decir, la fuerza de atracción entre los cationes y los
aniones.
¿Se forman moléculas?
No, se forman
redes cristalinas (ordenadas). Por tanto, los iones que se forman con
este enlace no forman moléculas aisladas sino que se agrupan de forma
ordenada en redes en las que el número de cargas positivas es igual al
de cargas negativas, compuesto es neutro. La fórmula que habitualmente
se da es una fórmula empírica.
Propiedades
*
Temperaturas de fusión y ebullición muy elevadas. Sólidos a temperatura
ambiente. La red cristalina es muy estable por lo que resulta muy
difícil romperla.
* Son duros (resistentes al rayado).
*
No conducen la electricidad en estado sólido, los iones en la red
cristalina están en posiciones fijas, no quedan partículas libres que
puedan conducir la corriente eléctrica.
* Son solubles en agua
por lo general, los iones quedan libres al disolverse y puede conducir
la electricidad en dicha situación.
* Al fundirse también se liberan de sus posiciones fijas los iones, pudiendo conducir la electricidad.
enlace covalente cloro
domingo, 7 de octubre de 2012
lunes, 1 de octubre de 2012
PRINCIPIO DE CONSTRUCCIÓN O DE AUF-BAU
En el estado
fundamental de un átomo, los electrones ocupan orbítales atómicos de tal
modo que la energía global del átomo sea mínima.
Se denomina principio de construcción (Aufbau) al procedimiento para deducir la configuración electrónica de un átomo, y consiste en seguir un orden para el llenado de los diferentes orbítales, basado en los diferentes valores de la energía de cada uno de ellos. Para recordarlo se utiliza el diagrama de Möller o de las diagonales, así como la regla de la mínima energía (n+l)..
Se denomina principio de construcción (Aufbau) al procedimiento para deducir la configuración electrónica de un átomo, y consiste en seguir un orden para el llenado de los diferentes orbítales, basado en los diferentes valores de la energía de cada uno de ellos. Para recordarlo se utiliza el diagrama de Möller o de las diagonales, así como la regla de la mínima energía (n+l)..
 ¡ES LO MISMO QUE LA CONFIGURACION ELECTRONICA LEER POR FAVOR NUEVAMENTE!
¡ES LO MISMO QUE LA CONFIGURACION ELECTRONICA LEER POR FAVOR NUEVAMENTE!
Configuracion electronica
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía.
Aunque el modelo de Scrödinger es exacto sólo para el átomo de
hidrógeno, para otros átomos es aplicable el mismo modelo mediante
aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal,
para ello debes seguir atentamente la flecha del esquema comenzando en
1s; siguiendo la flecha podrás ir completando los orbitales con los
electrones en forma correcta.
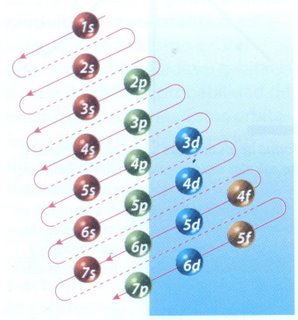
Para escribir la configuración electrónica de un átomo es necesario:
- Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Niels Bohr
Niels Bohr
(Niels Henrick David Bohr; Copenhague, 1885 - 1962)
Físico danés. Considerado como una de las figuras más deslumbrantes de
la Física contemporánea y, por sus aportaciones teóricas y sus trabajos
prácticos, como uno de los padres de la bomba atómica, fue galardonado
en 1922 con el Premio Nobel de Física, "por su investigación acerca de la estructura de los átomos y la radiación que emana de ellos".
Cursó
estudios superiores de Física en la Universidad de Copenhague, donde
obtuvo el grado de doctor en 1911. Tras haberse revelado como una firme
promesa en el campo de la Física Nuclear, pasó a Inglaterra para ampliar
sus conocimientos en el prestigioso Cavendish Laboratory de la
Universidad de Cambridge, bajo la tutela de sir Joseph John Thomson
(1856-1940), químico británico distinguido con el Premio Nobel en 1906
por sus estudios acerca del paso de la electricidad a través del
interior de los gases, que le habían permitido descubrir la partícula
bautizada luego por Stoney (1826-1911) como electrón.

Ecuacion de Scrodinger
El físico austríaco, Erwin Schrodinger, desarrolló en 1925 la conocida ecuación que lleva su nombre. Esta ecuación es de gran importancia en la mecánica cuántica, donde juega un papel central, de la misma manera que la segunda ley de Newton en la mecánica.
Fue entre 1925 y 1930, cuando apareció la teoría de la mecánica cuántica, de la mano de un grupo de investigadores, donde destacaba Erwin Schrödinger. Esta teoría fue importante, no sólo por su relevancia e importante papel en la ciencia, sino también por la gran cantidad de conceptos científicos implicados en ella.
Son muchos los conceptos previos implicados en la ecuación de Schrödinger, empezando por los modelos atómicos. Dalton, Thomson, Rutherford, Bohr, todos ellos contribuyeron al modelo atómico actual, ideado por Erwin Schrödinger, modelo conocido como “Ecuación de onda”. Esta es una ecuación matemática que tiene en consideración varios aspectos:
- La existencia de un núcleo atómico, donde se concentra la gran cantidad del volumen del átomo.
- Los niveles energéticos donde se distribuyen los electrones según su energía.
- La dualidad onda-partícula
- La probabilidad de encontrar al electrón
E = h ν
p = h / λ
Schrödinger trató de escribir una ecuación siguiendo la anterior predicción de De Broglie pero reduciendo las escalas macroscópicas e la ecuación de la mecánica clásica, expresandose la energñia mecánica total como:
E= p^2 / 2m + V ( r )
Max Born dio una
correcta interpretación física para la función de la función de
Schrödinger en 1926, sin embargo el carácter probabilístico introducido
por Schrödinger provocó mucha desconfianza en los físicos, incluso
aquellos con renombre, como por ejemplo, Albert Einstein.La solución de esta ecuación, fue la función de onda, siendo ésta, una medida de probabilidad de encontrar al electrón en un espacio, conocido como orbital.
Las funciones de onda se transforman con el tiempo, siendo su evolución temporal estudiada en la famosa ecuación del físico austríaco.
Otros conceptos utilizados por Schrödinger se basan en la óptica y la mecánica, y el paralelismo de ambas. A inicios de los años 30, Born le dio una interpretación probabilística distinta a la función de onda a la que De Broglie y Schrödinger habían dado, lo que le supuso el premio Nobel. En este trabajo, Born vio mediante formulas matriciales de mecánica cuántica, que los conjuntos cuánticos de estados, de manera natural construían espacios de Hilbert, para poder representar los estados físicos en cuántica.
Actualmente la ecuación se formula según la mecánica cuántica, donde el estado en un instante t, de un sistema definido por un elemento │Ψ ( t ) > en el espacio de Hilbert y usando la notación de Dirac , se pueden representar todos los resultados posibles de todas las medidas de un sistema.
Con la ecuación de Schrödinger describe la evolución temporal de │Ψ ( t ) > :
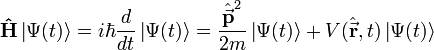
Niveles de energia
NIVELES DE ENERGIA
Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:
La Banda de Valencia y la Banda de Conducción.
La Banda de Valencia es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.
El átomo de Sodio (Na) tiene 11 electrones, 2 en la primera capa, 8 en la segunda y 1 en la tercera, y el Cloro (Cl) tiene 17 electrones, 2 en la primera, 8 en la segunda y 7 en la tercera. Debido a que todos los átomos tienden a tener 8 electrones en la última capa (regla del octete): el Sodio cederá 1 electrón al Cloro con lo que el primero se quedará con 8 electrones en su ahora última capa, en cambio el Cloro aceptará ese electrón pasando su última capa de tener 7 electrones a 8
Orbital
Orbital
Son los atomos que tienen niveles de energia, estos tienen subniveles, y estos a
su vez contienen orbitales, estos son "orbitas" donde los electrones
estan por parejas, ya que ada orbital acepta solamente 2 electrones!
practicamente el orbital es el lugar que ocupa una pareja de electrones dentro del subnivel.
Cada subnivel acepta diferentes numeros de orbitales
el subnivel S (acepta 2 electrones) = 1 orbital!
// P (acepta 6 electrones)= 3 orbitales
// D( acepta 10 electrones)= 5 orbitales
// F ( acepta 14 electrones)= 7 orbitales
practicamente el orbital es el lugar que ocupa una pareja de electrones dentro del subnivel.
Cada subnivel acepta diferentes numeros de orbitales
el subnivel S (acepta 2 electrones) = 1 orbital!
// P (acepta 6 electrones)= 3 orbitales
// D( acepta 10 electrones)= 5 orbitales
// F ( acepta 14 electrones)= 7 orbitales
Philip Allen Sharp
Philip Allen Sharp
(Falmouth, 1944) Químico e investigador norteamericano
que obtuvo el premio Nobel de Medicina en 1993 por sus descubrimientos
sobre la estructura de los genes. Realizó la carrera de Ciencias
Químicas en la Universidad de Illinois, estudió en el Instituto de
Tecnología de California, y de 1966 a 1969 fue investigador en el
departamento de Química de la Universidad de Illinois.
En
1964 contrajo matrimonio con Ann H. Holcombe, con quien tuvo tres
hijas. Entre 1969 y 1971 realizó estudios de postgrado en el laboratorio
del profesor Norman Davidson del Instituto Tecnológico de California.
En 1971 fue investigador en el laboratorio de Cold Spring Harbor, de
Nueva York, donde permaneció hasta 1974 y coincidió con el investigador
británico Richard J. Roberts.
Profesor asociado
(1974) y profesor desde 1979 del Centro para la Investigación sobre el
Cáncer, fue designado en 1982 director asociado de esta institución,
cargo en el que permaneció hasta 1985. Desde esa fecha desempeñó el
cargo de subdirector. Desde 1974 fue investigador del Instituto
Tecnológico de Massachusets, MIT, en Cambridge. En 1991 asumió el cargo
de director del departamento de Biología.
El 11 de
octubre de 1993 Phillip Sharp y Richard J. Roberts fueron galardonados
con el Premio Nobel de Medicina por sus descubrimientos sobre la
estructura de los genes. Ambos investigadores lograron descubrir, por
separado, que los genes pueden aparecer en el material genético en
varios segmentos bien diferenciados. Sharp había comenzado a investigar
este asunto en 1970.
lunes, 24 de septiembre de 2012
Practica N°1
Practica N° 1
“Propiedades
electromagnéticas de la materia –espectros de emisión”
Cuestionario de conceptos de antecedentes:
1.
1.-¿Cómo se electriza un cuerpo?
Cuando un cuerpo cargado eléctricamente se
pone en contacto con otro inicialmente neutro, puede transmitirle sus
propiedades eléctricas, existe, no
obstante, la posibilidad de electrizar un cuerpo neutro mediante otro cargado
sin ponerlo en contacto con él. Se trata, en este caso, de una electrización a
distancia o por inducción o influencia. Por último un cuerpo puede ser
electrizado por frotamiento con otro cuerpo.
2. 2.- ¿Cuáles son las propiedades eléctricas de la
materia?
El cómo un material responde a las fuerzas
eléctricas depende de cómo se hallen dispuestos sus átomos. Cuando los átomos
se hallan unidos juntos para formar sólidos, líquidos o gases, la forma en que
se hallan dispuestos los electrones depende de los detalles finos de las
fuerzas entre los átomos.
3. 3.- ¿A que se llama electrodo?
Es el material, conductor eléctrico, que
sufre una reacción electroquímica. Esta reacción se produce en la superficie en
contacto con el electrolito. Al electrodo donde se produce la reacción de
oxidación se le llama ánodo y al electrodo donde se produce la reducción,
cátodo.
4.
4.- ¿Cuál es la naturaleza de los rayos catódicos?
Después de algunos años que los rayos
catódicos fueron descubiertos, el estudio de sus propiedades mostró claramente
que ellos están constituídos de partículas que poseen carga eléctrica y masa
mecánica muy pequeñas.
Se observó también que esas partículas son
todas iguales, independientemente del metal del que fuese hecho el cátodo o
ánodo.
Se concluyó entonces que esas partículas
emitidas por el cátodo entran en la constitución de todos los cuerpos. Ellas
fueron llamadas electrones; los rayos
catódicos son electrones que son arrancados del cátodo por causa de la
diferencia de potencial existente entre el cátodo y el ánodo y son atraídos por
el ánodo
5. 5.- ¿Cuáles son los tipos de cargas eléctricas?
Son positivas y negativas.
6.
6.-¿Cuál es la naturaleza de la luz?
Maxwell se basó en los estudios de Faraday
del electromagnetismo, y concluyó que las ondas luminosas son de naturaleza
electromagnética. Una ONDA ELECTROMAGNÉTICA se produce por la variación en
algún lugar del espacio de las propiedades eléctricas y magnéticas de la
materia. No necesita ningún medio para propagarse, son ondas transversales.
7. 7.- ¿Por qué las sustancias emiten luz al
calentarlas?
Porque al calentar una sustancia lo que
haces es excitar los átomos que la componen, cuando se excita un átomo de un
objeto lo que ocurre es que los electrones de ese átomo saltan de sus orbitales
a uno de menor energía, cuando ocurre esto se despide energía en forma de luz,
o fotones.
8.
8.-¿A qué se le llama espectro luminoso?
Distribución de la energía que es irradiada
por una fuente luminosa, que viene ordenada por unos valores de longitud de
onda, es particular la secuencia matizada por la descomposición de los colores
del iris, como resultado de la descomposición de la luz solar que pasa a través
de un prisma refractor.
9.
9.-¿Qué es el espectro electromagnético?
Es un conjunto de ondas que van desde las
ondas con mayor longitud como las ondas de radio, hasta los que tienen menor
longitud como los rayos Gamma.
Entre estos dos límites están: las ondas de
radio, las microondas, los infrarrojos, la luz visible, la luz ultravioleta y
los rayos X
1 10.- ¿Por qué se dice que los espectros de línea son
como huellas dactilares?
Debido a que la sustancia que se utiliza para
analizar en el espectrofotómetro solo tiene esas cualidades, dicho de otra
manera ningún otro compuesto, sustancia, etc., tiene las mismas
características.
Experimento N°1 “Electrización por frotamiento y contacto”
1.- ¿Qué sucede al acercar la barra de plástico a
los pedacitos de papel?
Al acercar esta barra de plástico,
previamente frotada ya sea con la piel de conejo, o la seda, lo que sucedía, fue que los
pedacitos de papel se acercaron a ella, este fenómeno se puede explicar ya que,
la barra de plástico al sufrir la frotación, sufrió una excitación de sus
electrones, entonces, al momento de acercarse a los trocitos de papel, esta
excitación trabajo atrayéndolos a si.
2. 2.- ¿Qué se observa cuando se acerca la barra de vidrio
a los trocitos de papel?
Sucedía lo mismo que con la barra de
platico, solo que a menor carga, a ella se podía observar que solo se
levantaban un poco.
3.
3.-¿Qué sucedió al acercar las dos esferas? Explica
porque
Nada, puesto eran bolas de unicel, las cuales
son un aislante.
Experimento N°2 “Propiedades de los rayos catódicos”
1. 1.- ¿Cómo es la trayectoria de los rayos catódicos?
Es constante y en línea recta, en el caso
del experimento se pudo observar de color verde.
2. 2.- ¿Qué sucede con los rayos catódicos al acercar
el imán?
Al acercarse el imán se puede observar como
los rayos van siguiendo la trayectoria de este, sea cual sea la dirección de
dicho rayo.
3. 3.- ¿Qué observaste en el tubo con la cruz de Malta?
Se da una sombra
Con este tubo se puede observar que de da una
sombra, y la luz de este tubo es tenue y de color blanco
Experimento N°3 “Espectros de emisión”
Sustancia
|
Color de la flama
|
Observaciones
|
NaCl
|
Naranja
|
Apenas se puede notar el color de la flama a plena luz.
|
LiCl
|
Morado
|
Se confunde un poco con el color naranja, ya que se puede ver tonos
entre anaranjados y morados.
|
CaCl2
|
Naranja
|
Con esta sustancia se puede observar como salpicaba las flamas.
|
SrCl2
|
Rojo
|
Era rojo intenso, y la flama muy potente era lo que se podía
observar.
|
KCl
|
Entre café y morado
|
Aqui, al igual que en el caso de LiCl, se podía notar cambio de
colores, a momentos se percibía un poco el morado, pero también el café,
hasta que se pudo observar un punto medio.
|
viernes, 21 de septiembre de 2012
Estado basal y exitado
Estado basal y exitado
La configuración (en estado fundamental o basal) del Ca (Z=20) es:
1s2, 2s2, 2p6, 3s2, 3p6, 4s2
o también: [Ar], 4s2
El estado excitado de un elemento es cuando se le sumistra energía y algunos de sus átomos pasan a un nivel de energía mayor. El mismo ejemplo para el Ca
1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d1
Aquí se ve claramente cómo uno de lso electrones del calcio pasan a un nivel de energía mayor. No importa que sólo haya un electrón en el 4s, ya que no viola ninguna de las reglas para las configuraciones (de hecho en este caso atiende a la regla de "máxima estabilidad de lo orbitales" que dice: los orbitales son más estables cuando están totalmente llenos o semillenos)
El estado imposible de un átomo de igual manera se basa en las configuraciones electrónicas y normalmente desatiende, ya sea, el "Principio de exclusión de Pauli" o el "Principio de máxima estabilidad o regla de Hund".
El primero dice que los electrones de un átomo no pueden tener sus cuatro números cuánticos iguales y el segundo se basa en los orbitales p, d y f (en su llenado):
Si consideramos que todos los electrones del estado basal están correctos, entonces lo explicaré con los den nivel 4s:
.... 4s: 1er electrón: (4,0,0,+1/2); 2do electrón (4,0,0,+1/2)
Si observas, éstos dos últimos electrones violan el "Principio de exclusión de Pauli".
El correcto sería:
... 4s: 1er electrón (4,0,0,+1/2); 2do electrón (4,0,0,-1/2)
1s2, 2s2, 2p6, 3s2, 3p6, 4s2
o también: [Ar], 4s2
El estado excitado de un elemento es cuando se le sumistra energía y algunos de sus átomos pasan a un nivel de energía mayor. El mismo ejemplo para el Ca
1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d1
Aquí se ve claramente cómo uno de lso electrones del calcio pasan a un nivel de energía mayor. No importa que sólo haya un electrón en el 4s, ya que no viola ninguna de las reglas para las configuraciones (de hecho en este caso atiende a la regla de "máxima estabilidad de lo orbitales" que dice: los orbitales son más estables cuando están totalmente llenos o semillenos)
El estado imposible de un átomo de igual manera se basa en las configuraciones electrónicas y normalmente desatiende, ya sea, el "Principio de exclusión de Pauli" o el "Principio de máxima estabilidad o regla de Hund".
El primero dice que los electrones de un átomo no pueden tener sus cuatro números cuánticos iguales y el segundo se basa en los orbitales p, d y f (en su llenado):
Si consideramos que todos los electrones del estado basal están correctos, entonces lo explicaré con los den nivel 4s:
.... 4s: 1er electrón: (4,0,0,+1/2); 2do electrón (4,0,0,+1/2)
Si observas, éstos dos últimos electrones violan el "Principio de exclusión de Pauli".
El correcto sería:
... 4s: 1er electrón (4,0,0,+1/2); 2do electrón (4,0,0,-1/2)
Ley de las proporciones constantes o de "Proust"
Ley de las proporciones constantes o de "Proust"
Una de las observaciones fundamentales de la química moderna hecha por
Joseph Proust, la ley de las proporciones constantes, dice: "Cuando se
combinan dos o más elementos para dar un determinado compuesto, siempre
lo hacen en una relación de masas constantes”. Eso significa que siempre
va a ser igual el porcentaje de cada uno de los elementos no importando
si solo se combinan 10 g o 1000 g; esta ley se utiliza cuando hay un
reactivo ilimitado en la naturaleza.
La ley de Dalton o ley de las proporciones múltiples formulada en 1803 por John Dalton, Esta ley afirma que cuando dos elementos se combinan para originar diferentes compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro se combinan con dicha cantidad fija para dar como producto los compuestos, están en relación de números enteros sencillos. Es decir, que cuando dos elementos A y B forman más de un compuesto, las cantidades de A que se combinan en estos compuestos, con una cantidad fija de B, están en relación de números enteros sencillos.
La ley de Dalton o ley de las proporciones múltiples formulada en 1803 por John Dalton, Esta ley afirma que cuando dos elementos se combinan para originar diferentes compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro se combinan con dicha cantidad fija para dar como producto los compuestos, están en relación de números enteros sencillos. Es decir, que cuando dos elementos A y B forman más de un compuesto, las cantidades de A que se combinan en estos compuestos, con una cantidad fija de B, están en relación de números enteros sencillos.
"Si se tienen 2 ó más elementos y estos forman un compuesto. La relacion en masa de los elementos en el compuesto es siempre lo mismo...."
(Constante definida)
Ejemplo:
H2O
H: 1.00x2=2.00 u.m.a
H: 1.00x2=2.00 u.m.a
O: 15.99x1=15.99 u.m.a
17.99 u.m.a
17.99 u.m.a
H
17.99 u.m.a----100%
2.00 u.m.a ------ x
x= 2.00 u.m.a x 100%
17.99 u.m.a
x= 11.11
O
17.99 u.m.a ---- 100%
15.99 u.m.a
x= 88.88
x= 88.88
Ejercicio:
1.- Aplicando la ley de las proporciones constantes determinar la relacion (porcentajes de cada uno de los elementos) de las siguientes sustancias.
a) HNO3
b) Br2
a)
H: 1.00 x 1 = 1.00 u.m.a
N: 14.00 x 1 = 14.00 u.m.a
O: 15.99 x 3 = 47.97 u.m.a
H: 1.00 x 1 = 1.00 u.m.a
N: 14.00 x 1 = 14.00 u.m.a
O: 15.99 x 3 = 47.97 u.m.a
62.97 u.m.a
H
62.97- 100%
1.00
x= 1.5880
N
62.97- 100%
14.00
x= 22.23
O
62.97- 100%
47.97
x= 76.17
b)
Br
159.8-100%
79.90
Ley de la conservacion de la energia
Ley de la conservacion de la energia
"La energia no se crea ni se destruye solo se transforma."
La ley de la conservación de la energía constituye el primer principio de la termodinámica y afirma que la cantidad total de energía en cualquier sistema aislado (sin interacción con ningún otro sistema) permanece invariable con el tiempo, aunque dicha energía puede transformarse en otra forma de energía. En resumen, la ley de la conservación de la energía afirma que la energía no puede crearse ni destruirse, sólo se puede cambiar de una forma a otra, por ejemplo, cuando la energía eléctrica se transforma en energía calorífica en un calefactor.
Ejemplos:
= 694.38
142.62 + 503.76 = 694.38 =562.44 + 59.96 + 71.96
3Cu+ 8HNO3 -> 3Cu(NO3) + 2NO + 4H20
Cu: 63.54 u.m.a
x3
192.62
x3
192.62
HNO3
H: 1.00x1=1.00
N: 14.00x1= 14.00
O : 15.99x3= 47.97
67.97
x8
503.76
x8
503.76
Cu: 63.54x1= 53.54
N: 14.00x2= 28.00
O: 15.99x6= 95.94
187.48
x3
x3
562.44
NO
N: 14.00x1= 14.00
O: 15.99x1= 15.99
29.99
x2
59.98
HO
59.98
HO
H: 1.00x2= 2.00
0: 15.99x2= 15.99
17.99
x4
x4
71.96
Cu- Cu (N03) 2
190.62 ton 564.44 ton
190.62 ton 564.44 ton
x1
x= 190.62 ton Cux1 ton Cu (N03)2
John Dalton
John Dalton
(Eaglesfield, Gran Bretaña, 1766-Manchester, 1844) Químico y físico
británico. En su infancia ayudaba con su hermano a su padre en el
trabajo del campo y de la pequeña tienda familiar donde tejían vestidos,
mientras que su hermana Mary ayudaba a su madre en las tareas de la
casa y vendía papel, tinta y plumas.
Aunque su situación económica era bastante humilde,
recibieron cierta educación en la escuela cuáquera más cercana, a
diferencia de otros niños de la misma condición. El maestro de la
escuela cuáquera de Pardshow Hall proporcionó a Jonh Dalton una buena
base y le transmitió afán por la búsqueda incansable de nuevos
conocimientos. Un cuáquero rico, Elihu Robinson, se convirtió en su
mentor y en otra fuente de estimulación hacia las matemáticas y las
ciencias (especialmente la meteorología).
Con sólo 12
años de edad Jonh Dalton abrió una escuela en su localidad natal,
Eaglesfield. Aunque supo manejar los problemas con sus alumnos mayores
que él, después de dos años tuvo que abandonar su proyecto debido al
bajo salario, y tuvo que volver a las tareas del campo trabajando para
un tío suyo.
En 1781 Jonh Dalton se unió a su
hermano como asistente de George Bewley en su escuela de Kendall. Cuando
se retiró George, su hermano y él abrieron su propia escuela, donde
ofrecían clases de inglés, latín, griego y francés, además de 21 temas
relacionados con las matemáticas y las ciencias. Su hermana se trasladó
con ellos para ayudarles en la casa. A pesar de tener unos 60 alumnos, a
veces se veían obligados a trabajar en tareas auxiliares para
mantenerse.
John Gough, el hijo ciego de un rico comerciante, se
hizo amigo de John Dalton y su mentor. Le enseñó lenguas, matemáticas y
óptica, además de compartir con Dalton su biblioteca. El interés de
Dalton se extendió hacia la neumática, la astronomía y la geografía, y
en 1787 comenzó a obtener ingresos extraordinarios impartiendo
conferencias. También se dirigió a un museo cercano con una oferta para
vender los once volúmenes clasificados de su colección botánica.
Coleccionaba mariposas y estudiaba los caracoles, las garrapatas y los
gusanos. También medía su ingesta de alimentos y la comparaba con los
residuos producidos por sus organismo. Preparaba su ingreso en la
escuela de medicina, pero su familia lo desanimó por falta de dinero y
de confianza en él.
A la edad de 26 años (1792),
Dalton descubrió que ni él ni su hermano eran capaces de distinguir los
colores. Le regaló a su madre unas medias (que él creía azules) y ella
le preguntó sorprendida cuál era la razón por la que le daba unas medias
de color escarlata, que no era apropiado para una mujer cuáquera. En su
primer artículo científico importante, John Dalton proporcionó una
descripción científica sobre este fenómeno que posteriormente se conoció
con el nombre de daltonismo.
En 1793, se trasladó a Manchester como tutor en el Nuevo
Colegio fundado por los presbiterianos. Inmediatamente se inscribió en
la Biblioteca de Manchester y en la Sociedad Filosófica (que llegaría a
presidir). En ese mismo año Dalton publicó su primer libro Meteorological Observations and Essays,
donde defendía la tesis de que el aire es una mezcla física de gases en
lugar de una combinación química. Como tutor de química conocía la obra
de Lavoisier.
En 1802 estableció su ley de las
presiones parciales (Ley de Dalton). Cuando dos fluidos elásticos A y B
se mezclan, no hay repulsión entre una partícula de A y otra de B, pero
sí entre una partícula de B y otra partícula de B. También estableció
una relación entre la presión de vapor y la temperatura. Su interés en
los gases se derivaba de su afición a los estudios meteorológicos:
siempre llevaba consigo sus aparatos del tiempo allí donde fuese,
realizando a lo largo de su vida más de doscientas mil observaciones que
anotaba en su diario constantemente. Gracias a estas observaciones, su
mente analítica pudo encontrar relaciones numéricas entre los datos.
En
1803, mientras trataba de explicar su ley de presiones parciales,
comenzó a formular su mayor contribución a la ciencia: la teoría
atómica. Se encontraba estudiando la reacción del óxido nítrico con
oxígeno cuando descubrió que la reacción podía tener lugar con dos
proporciones diferentes: a veces 1:1,7 y otras 1;3,4 (en peso). Ello
llevó a Dalton a establecer la ley de las proporciones múltiples, que
dice que los pesos de dos elementos siempre se combinan entre sí en
proporciones de números enteros pequeños. En ese mismo año publicó su
primera lista de pesos atómicos y símbolos.
Empirismo
Empirismo.
La filosofia empirista llevo a cabo una saludable autocritica de la razon, delimito sus limites y restringio sus posibilidades asentandola en el ambito de la experiencia.
Historia.
El empirismo es una corriente filosofica opuesta al racionalismo que surge en Inglaterra en el siglo XVII y que se extiende durante el siglo XVIII y cuyos maximos representantes.
J. Locke (1632-1704), J. Berkley (1683-1753) y D.Hume (1711-1776).
En un sentido bastante general, se denomina empirismo a toda teoria que considere que la experienca es el origen del conocimiento, pero no se limite. Esta filosofia, como por ejemlo, Aristoteles (384 a.c), Epicuro (341-272 a.c) los estoicos (S. IV a.C- S. II d.C), Tomas de Aquino (1224- 1274) y ockham (1295-1350). Sin embargo, en un sentido estricto, el empirismo propiamente dicho hace relacion a las teorias filosoficas creadas por las corrientes antes mencionadas.
Los caracteres fundamentales del empirismo podrian resumirse en las siguientes tesis:
1.- Subjetivismo del conocimiento
2.- La experiencia como unica fuente del conocimiento.
3.- Negacion de las ideas innatas de los racionalistas.
4.- El conocimiento humano es limitado: La experiencia es su limite.
5.- Negacion del valor objetivo de los conceptos universales.
6.- El metodo experimental y la ciencia empirica.
7.- Los predicados como bueno o malo no se dan en la experiencia.
Agua y Fuego
Definicion de las siguientes mezclas
¿Que es el agua?
El agua es una mezcla de 2 ó mas compuestos
¿Que es el Fuego?
El fuego es un fenomeno fisico-quimico que se caracteriza por el desprendimiento de luz y calor, producido por la combustion de un cuerpo.
Para que el proceso de la combustion se inicie y pueda continuar deben estar presentes, manteniendo entre su una adecuada proporcion, (tres elementos).
Combustible, Oxigeno y Calor
°Combustible: Para el caso de los incendios, forestales se considera combustible todo material de origen vegetal, independientemente de su estado, condicion ó ubicacion. En estos materiales el compuesto basico es la celulosa.
(ramas, hierbas, arboles, raices, etc)
Cada combustible tiene una temperatura de ignicion distinta a la que es necesario llegar para inflamarlo. En la mayoria de los casos, una vez que comienza la reaccion de oxidacion, el calor desprendiendo en el proceso sirve para mantenerlo.
°Oxigeno: Es un gas que se encuentra en el aire (02)
°Calor: Es una forma de energia medible atraves de la temperatura produce calor el sol, un rayo, la llama de un fosforo, etc.
°Calor: Es una forma de energia medible atraves de la temperatura produce calor el sol, un rayo, la llama de un fosforo, etc.
La combustion es un proceso fisico-quimico que consisten en una oxidacion rapida que se lleva a cabo a altas temperaturas consumiendo oxigeno y combustible y que deja como resultado final un residuo que consiste mayormente en sales minerales (cenizas).
CELULOSA + O2 + ENERGIA = CO2 + VAPOR DE H2O + CALOR = FUEGO
El triangulo del Fuego
El traingulo del fuego representa graficamente los 3 elementos de la combustion. La combustion se interrumpe y el fuego se extingue cuando uno ó más de dichos componentes dejan intervenir en la reaccion.
El objetivo final de las estrategias y tacticas de combate es precisamente tratar de romper esa relacion eliminando uno ó más de los lados del triangulo.
La mol
Mol
La mol es la masa expresada en gramos de algunas sustancias
Ejemplos de la Mol:
1 mol "x"= M(g) "x" 1 mol "x"= 6.02x1023 particulas "x"
1 mol Cu= 63.54 g Cu 1 mol Cu= 6.02x1023 atomos Cu
1 mol Cu= 63.54 g Cu 1 mol Cu= 6.02x1023 atomos Cu
1 mol H2O= 18 (g) H2O 1 mol H20= 6.02x1023 particulas H20
M (g) "x" = 6.02x1023 particulas "x"
63.54g Cu= 6.02x1023 atomos Cu
18.0 g H20= 6.02x1023 moleculas H20
63.54g Cu= 6.02x1023 atomos Cu
18.0 g H20= 6.02x1023 moleculas H20
63.54 g Cu= 6.02000000000.0 atomos de Cu

Suscribirse a:
Entradas (Atom)





































